Higher bioactivity cannabidiol in greater concentration more greatly reduces valvular interstitial cell calcification
より高濃度の生物活性カンナビジオールは、より大きく弁膜間質細胞の石灰化を抑制する。
D. Cushing1*, D. Goakar2, & B. Joseph1,2 1: Peak Health Center, Los Gatos, CA 2: ImmunAG LLP, Goa, India
概要
弁膜間質細胞(VICs)は、心臓弁の恒常性と構造的な弁膜の完全性に不可欠である。VICsの異常 な石灰化は、石灰性大動脈弁疾患を含む危険な疾患につながる。VICの石灰化は、CB2受容体の 選択的拮抗作用によるMAPK/ERKカスケードの調節を通じて減少させることができる。これは、 カンナビジオール(CBD)のターゲットとしてよく研究されているものです。近年、すべての CBD試料が同じ程度の生物活性の可能性(bioactivity)を持つわけではないことが、次第に理解 されるようになってきた。本研究では、CBDの生理活性のレベルがVIC石灰化抑制に異なる影響 を及ぼすかどうかを明らかにしようとするものである。豚の大動脈弁の葉からVICを単離し、石灰 化を誘導し、CBDで処理するか、または未処理のままとした。生物活性の異なるCBDを四捨五入 して8つのレベル(.20, .30, .50, .60, .70, .80, .90, and .95.)に分類した。5, 10, 25, 40, 100 mgの濃度を検討した。生物活性とmg濃度の組み合わせごとに、平均値、標準偏差、石灰化減少 の最小値、最大値を示した。mg濃度で2つの1×5反復測定ANOVAを行い、それぞれ生理活性 を.20と.95に保持した。2×2 robust mixed ANOVAでは、生理活性とmg濃度の間の相互作用が 確認された(psihat = -36.5, p < 0.001)。石灰化は,生物活性0.95,濃度100 mgの処理で最 も減少した(M = 55%,SD = 6.66%).これらの結果は、CBDをVIC石灰化減少の治療法とし て考える場合、生物活性が中心的な重要性を持つことを示しています。
ヒトの心臓弁は、複雑な多室型ポンプの中にある、しなやかで流量を調節する膜である(Mohler ら、2001;Butcher、Simmons、&Warnock、2008)。これらの弁の中には、細胞外マトリッ クスの中に、弁膜間質細胞(VICs)が存在し、これは心臓弁の恒常性と構造的な葉の完全性に不 可欠である(Hjortnaes et al.、2015; Taylor, Batten, Brand, Thomas, & Yacoub、2003)。VIC の石灰化は、間質細胞の力学的表現型の崩壊を引き起こし、間質マトリックスの無秩序化、結節 形成、および石灰化促進シグナル伝達を駆動します(Farrar, Pramil, Richards, Mosher, & Butcher, 2016)。これは、任意の数の心臓のジストロフィック石灰化疾患につながり、それぞ れが他の心血管疾患(例えば、弁膜狭窄症、Michel & Dipchand, 2017; de Simone et al., 2010; Gerdts et al., 2015参照)発症のリスクを高める可能性がある。 心血管石灰化抑制のための新規治療標的には、カンナビノイド受容体2(CB2;Kaschina, 2016)が含まれます。CB2は、破骨細胞、骨芽細胞、および骨細胞に存在する(Ofekら、2006; Idris, Sophocleous, Landao-Bassonga, van’t Hof, & Ralston, 2008; Idrisら, 2005)。CB2 は、石灰化した心臓弁においてアップレギュレートされている(Naito et al.、2010)。アナンダ ミドのようなCB2アゴニストは、細胞外シグナル制御キナーゼ(ERK)活性化を刺激することが 示されている(McAllister & Glass, 2002)。ERKの活性化が大きいと、VICにおける石灰沈着 性結節の形成がより大きくなる(Gu & Masters, 2009)。従って、CB2のアンタゴニズムまた はインバースアゴニズムは、石灰化の減少をもたらすはずである。
カンナビジオール(CBD)は、カンナビス・サティバ(Ligresti Petrocellis, & Di Marzo, 2016) および最近、カンナビス以外のソース(Kriya Brand Humulus; Cushing, Kristipati, Shastri & Joseph, 2018参照)で見られる主要非精神薬成分である。CBDは、CB2においてインバースアゴ ニストまたはアンタゴニストとして作用する(Thomas, Baillie, Phillips, Razdan, Ross, & Pertwee, 2007)。CBDは、G共役タンパク質受容体55(GPR55;Whyteら、2009)1の拮抗 を介して、破骨細胞形成を抑制するが、破骨細胞機能を刺激する。
本研究では、様々な生物活性(Cushing, Kristipati, Shastri, & Joseph, 2018参照)のCBD試料 と様々なmg濃度がin vitroでブタVICの石灰化に及ぼす影響を検討する。CBDで処理したVICサン プルの石灰化が少ない場合、これはCBDを弁膜症石灰化疾患の予防的治療の可能性として示唆す るものである。CBDの生物活性が石灰化の減少の大きさに影響するならば、これは科学的実験の 前に生物活性レベルを検証することの重要性を再度強調することになるであろう。もし、より高 い生物活性のCBDが石灰化のより大きな減少に対応するならば、より高い生物活性のCBDが医療 専門家によって好まれるべきことを示唆するでしょう。
より高濃度の生物活性カンナビジオールは、より大きく弁膜間質細胞の石灰化を抑制する。
D. Cushing1*, D. Goakar2, & B. Joseph1,2 1: Peak Health Center, Los Gatos, CA 2: ImmunAG LLP, Goa, India
概要
弁膜間質細胞(VICs)は、心臓弁の恒常性と構造的な弁膜の完全性に不可欠である。VICsの異常 な石灰化は、石灰性大動脈弁疾患を含む危険な疾患につながる。VICの石灰化は、CB2受容体の 選択的拮抗作用によるMAPK/ERKカスケードの調節を通じて減少させることができる。これは、 カンナビジオール(CBD)のターゲットとしてよく研究されているものです。近年、すべての CBD試料が同じ程度の生物活性の可能性(bioactivity)を持つわけではないことが、次第に理解 されるようになってきた。本研究では、CBDの生理活性のレベルがVIC石灰化抑制に異なる影響 を及ぼすかどうかを明らかにしようとするものである。豚の大動脈弁の葉からVICを単離し、石灰 化を誘導し、CBDで処理するか、または未処理のままとした。生物活性の異なるCBDを四捨五入 して8つのレベル(.20, .30, .50, .60, .70, .80, .90, and .95.)に分類した。5, 10, 25, 40, 100 mgの濃度を検討した。生物活性とmg濃度の組み合わせごとに、平均値、標準偏差、石灰化減少 の最小値、最大値を示した。mg濃度で2つの1×5反復測定ANOVAを行い、それぞれ生理活性 を.20と.95に保持した。2×2 robust mixed ANOVAでは、生理活性とmg濃度の間の相互作用が 確認された(psihat = -36.5, p < 0.001)。石灰化は,生物活性0.95,濃度100 mgの処理で最 も減少した(M = 55%,SD = 6.66%).これらの結果は、CBDをVIC石灰化減少の治療法とし て考える場合、生物活性が中心的な重要性を持つことを示しています。
ヒトの心臓弁は、複雑な多室型ポンプの中にある、しなやかで流量を調節する膜である(Mohler ら、2001;Butcher、Simmons、&Warnock、2008)。これらの弁の中には、細胞外マトリッ クスの中に、弁膜間質細胞(VICs)が存在し、これは心臓弁の恒常性と構造的な葉の完全性に不 可欠である(Hjortnaes et al.、2015; Taylor, Batten, Brand, Thomas, & Yacoub、2003)。VIC の石灰化は、間質細胞の力学的表現型の崩壊を引き起こし、間質マトリックスの無秩序化、結節 形成、および石灰化促進シグナル伝達を駆動します(Farrar, Pramil, Richards, Mosher, & Butcher, 2016)。これは、任意の数の心臓のジストロフィック石灰化疾患につながり、それぞ れが他の心血管疾患(例えば、弁膜狭窄症、Michel & Dipchand, 2017; de Simone et al., 2010; Gerdts et al., 2015参照)発症のリスクを高める可能性がある。 心血管石灰化抑制のための新規治療標的には、カンナビノイド受容体2(CB2;Kaschina, 2016)が含まれます。CB2は、破骨細胞、骨芽細胞、および骨細胞に存在する(Ofekら、2006; Idris, Sophocleous, Landao-Bassonga, van’t Hof, & Ralston, 2008; Idrisら, 2005)。CB2 は、石灰化した心臓弁においてアップレギュレートされている(Naito et al.、2010)。アナンダ ミドのようなCB2アゴニストは、細胞外シグナル制御キナーゼ(ERK)活性化を刺激することが 示されている(McAllister & Glass, 2002)。ERKの活性化が大きいと、VICにおける石灰沈着 性結節の形成がより大きくなる(Gu & Masters, 2009)。従って、CB2のアンタゴニズムまた はインバースアゴニズムは、石灰化の減少をもたらすはずである。
カンナビジオール(CBD)は、カンナビス・サティバ(Ligresti Petrocellis, & Di Marzo, 2016) および最近、カンナビス以外のソース(Kriya Brand Humulus; Cushing, Kristipati, Shastri & Joseph, 2018参照)で見られる主要非精神薬成分である。CBDは、CB2においてインバースアゴ ニストまたはアンタゴニストとして作用する(Thomas, Baillie, Phillips, Razdan, Ross, & Pertwee, 2007)。CBDは、G共役タンパク質受容体55(GPR55;Whyteら、2009)1の拮抗 を介して、破骨細胞形成を抑制するが、破骨細胞機能を刺激する。
本研究では、様々な生物活性(Cushing, Kristipati, Shastri, & Joseph, 2018参照)のCBD試料 と様々なmg濃度がin vitroでブタVICの石灰化に及ぼす影響を検討する。CBDで処理したVICサン プルの石灰化が少ない場合、これはCBDを弁膜症石灰化疾患の予防的治療の可能性として示唆す るものである。CBDの生物活性が石灰化の減少の大きさに影響するならば、これは科学的実験の 前に生物活性レベルを検証することの重要性を再度強調することになるであろう。もし、より高 い生物活性のCBDが石灰化のより大きな減少に対応するならば、より高い生物活性のCBDが医療 専門家によって好まれるべきことを示唆するでしょう。
結果
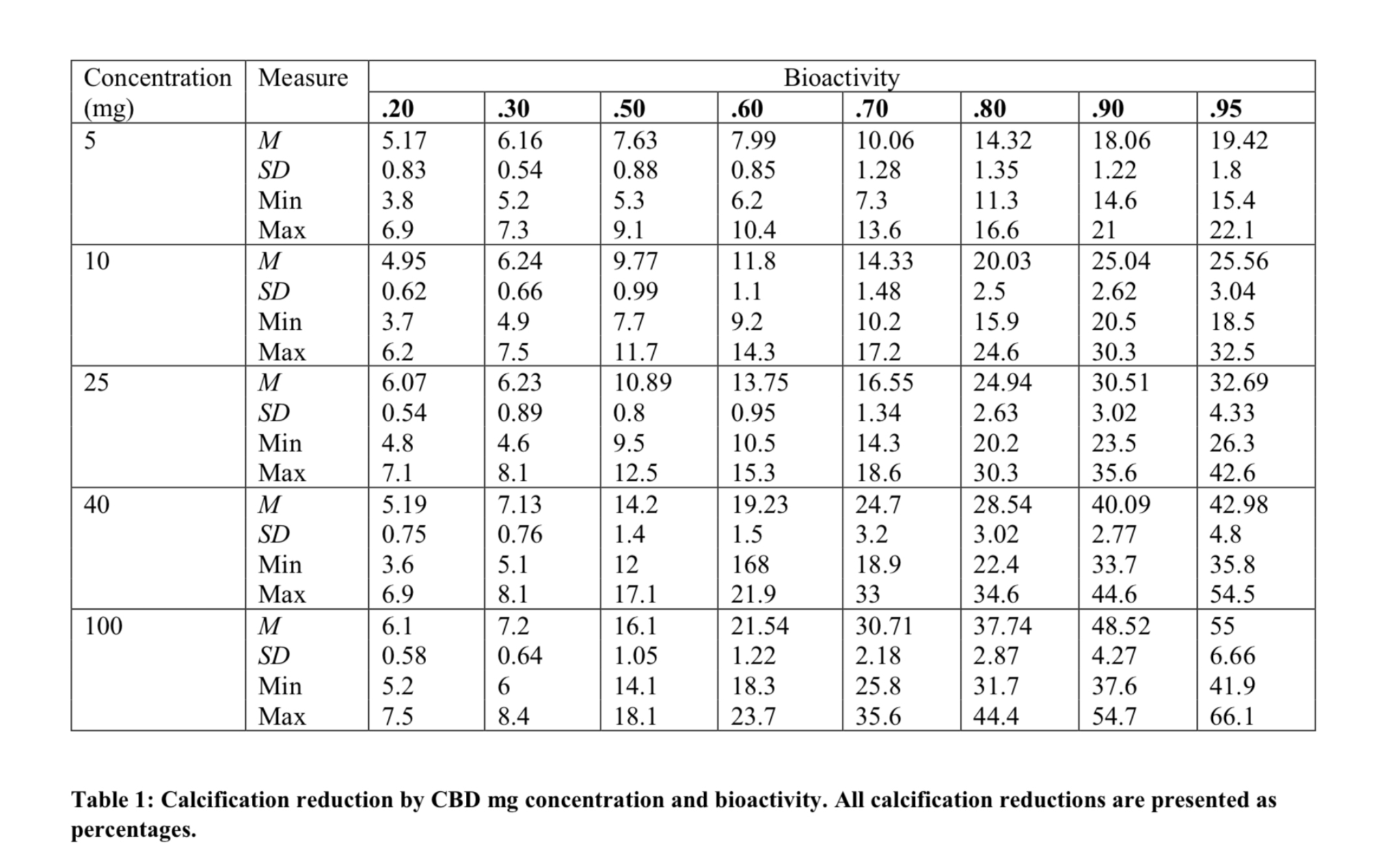
27 種類の組織サンプルから採取した石灰化 VICs を含むマルチプレートウェルは、8 種類の生物 活性と 5 種類の mg 濃度の CBD で処理するか、または未処理のままとした。平均石灰化度は、 ウェルあたりの結節数と結節あたりの平均面積で計算された。未処理のウェルの平均総結節面積 は、ウェルあたり3.27 mm2 (SD = 0.32, min = 0.5, max = 4.0)であった。報告された石灰化減 少率はすべて、3.27 mm2 から処理したウェルの平均結節面積を除算したものである。CBDサン プルは、値、.20、.30、.50、.60、.70、.80、.90、.95の周りの生物活性レベルに従ってクラス ター化された。Mgの投与量は、5、10、25、40、100で検討した。
弁石灰化は、しばしば炎症と同時に起こることは注目に値する。CBDは、おそらくTRPV1、 TRPV2、およびTRPA1(Petrocellisら、2011;Qinら、2008;Bisognoら、2001;Costaら、 2004)、5HT1α受容体(Pazosら、2004)など複数の活性依存経路の動的制御に負う抗炎症 性がある。2013)、グリシン受容体(Ahrensら、2009)、TRPM8チャネル(De Petrocellis ら、2011)、T型電圧依存性カルシウムチャネル(Ross、Napier、&Connor、2008)、Gタ ンパク質共役受容体GPR55(Ross、2009)およびいくつかの他のもの(総合レビューについて は、Frenchら、2017)参照)。これらの経路はまた、直接的に、または間接的に、石灰化に影 響を与える可能性がある(例えば、Whyteら、2009年)。CB2は、多くの免疫調節作用および 抗炎症作用も伝達する(Mukhopadhyayら、2010;Steffensら、2005)。
27 種類の組織サンプルから採取した石灰化 VICs を含むマルチプレートウェルは、8 種類の生物 活性と 5 種類の mg 濃度の CBD で処理するか、または未処理のままとした。平均石灰化度は、 ウェルあたりの結節数と結節あたりの平均面積で計算された。未処理のウェルの平均総結節面積 は、ウェルあたり3.27 mm2 (SD = 0.32, min = 0.5, max = 4.0)であった。報告された石灰化減 少率はすべて、3.27 mm2 から処理したウェルの平均結節面積を除算したものである。CBDサン プルは、値、.20、.30、.50、.60、.70、.80、.90、.95の周りの生物活性レベルに従ってクラス ター化された。Mgの投与量は、5、10、25、40、100で検討した。
弁石灰化は、しばしば炎症と同時に起こることは注目に値する。CBDは、おそらくTRPV1、 TRPV2、およびTRPA1(Petrocellisら、2011;Qinら、2008;Bisognoら、2001;Costaら、 2004)、5HT1α受容体(Pazosら、2004)など複数の活性依存経路の動的制御に負う抗炎症 性がある。2013)、グリシン受容体(Ahrensら、2009)、TRPM8チャネル(De Petrocellis ら、2011)、T型電圧依存性カルシウムチャネル(Ross、Napier、&Connor、2008)、Gタ ンパク質共役受容体GPR55(Ross、2009)およびいくつかの他のもの(総合レビューについて は、Frenchら、2017)参照)。これらの経路はまた、直接的に、または間接的に、石灰化に影 響を与える可能性がある(例えば、Whyteら、2009年)。CB2は、多くの免疫調節作用および 抗炎症作用も伝達する(Mukhopadhyayら、2010;Steffensら、2005)。
探索的データ解析
表 1 に、試験した各 mg 濃度の生物活性レベルの平均値、標準偏差、最小値、最大値を示す。(生 物活性が高いほど、また濃度が高いほど、石灰化が抑制されることがわかった。5つの濃度すべて において、生物活性が高くなると、石灰化は指数関数的に減少するように見えた(図1参照)。各 サンプルの石灰化の減少のばらつきも、生物活性が高くなるにつれて大きくなった。例えば、最 も減少率の高いグループ(100 mg、生物活性0.95)は、40%から67%の減少を示した(M =55%)。このグループはまた、最も大きな標準偏差(SD = 6.66%)を有していた。減少率が高く なるとばらつきが大きくなるが、生物活性のレベル間には意味のある違いがあるように思われ た。例えば、すべてのmg濃度において、0.95の生物活性CBDによって誘発された最小石灰化減少 は、0.70の生物活性CBDによって誘発された最大石灰化減少より依然として大きかった。
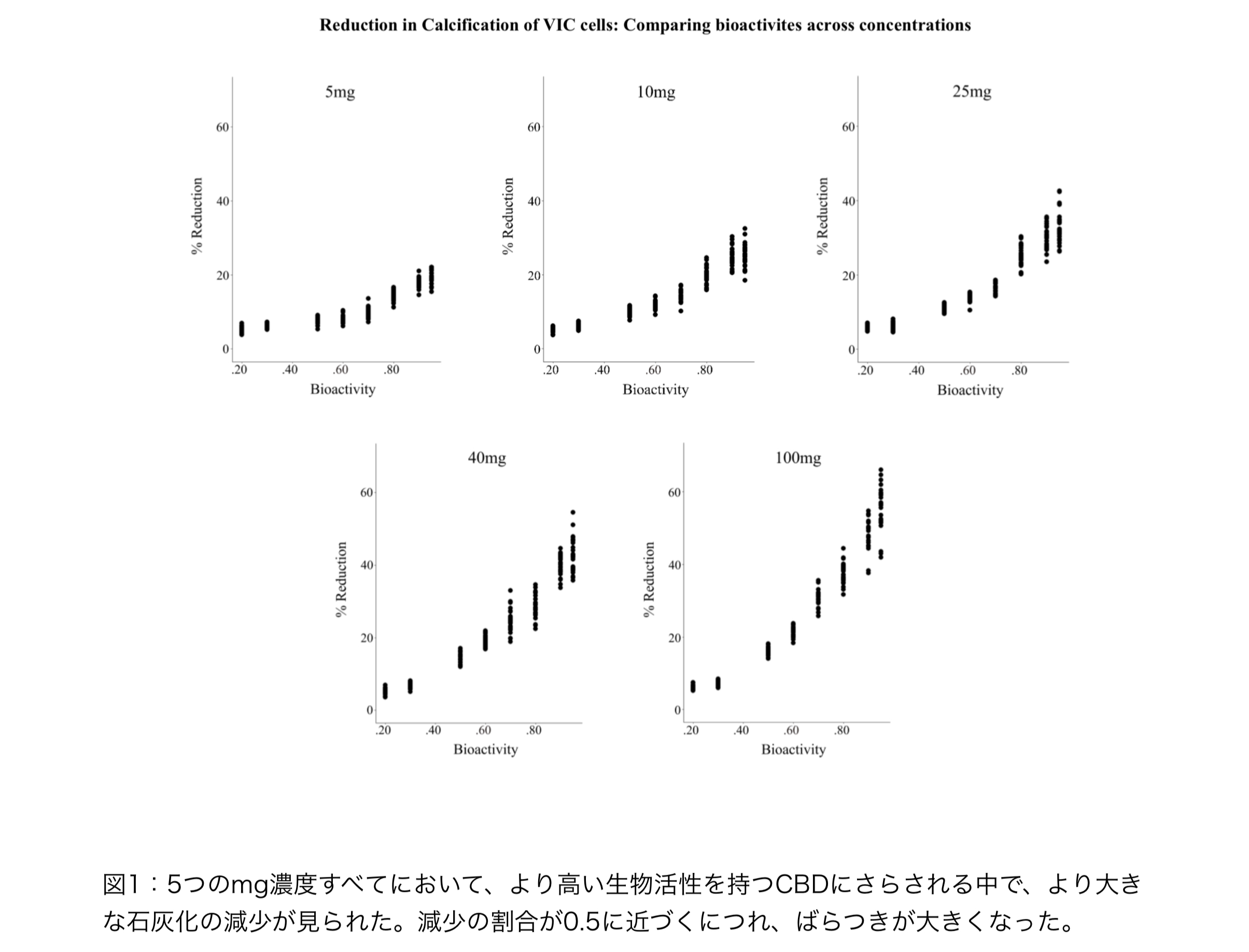
低生物活性のCBDをmg濃度で比較する
0.20生物活性CBDで処理したVICサンプルの様々なmg濃度(5、10、25、40、100)の間に違い が存在するかどうかを調べるために、1×5の反復測定ANOVAを実施しました(図2参照)。 Mauchleyの検定は、サンプル間の球形性の仮定に違反しないことを見出した、W = 0.759, p = 0.667.RM ANOVAでは、0.20生物活性試験群におけるVIC石灰化減少について投与量間の有意差 が認められた、F(4, 104) = 18.90, p < .001, η2G = .354。ボンフェローニ補正を用いたポスト ホック比較では、25mgと100mgの投与量にさらされた試験サンプルは、5、10、40mgの投与 量よりもVIC石灰化の減少が大きいことが示された。すべての有意なpost-hoc比較において、p < 0.001であった。これらの平均値間の差は小さかった(すべてMdiff < 1.15%)。
高生物活性のCBDをmg濃度で比較する
生物活性0.95のCBDで処理したVICサンプルにおいて、様々なmg濃度の間に違いが存在するかど うかを調べるために、1×5の反復測定ANOVAを実施しました(図2参照)。Mauchleyのテスト は、球形性の仮定に違反する可能性があることを発見しました。Greenhouse-Geisser補正によ る反復測定ANOVAは、0.95生物活性試験群内のVIC石灰化について投与量間の有意差を見出し た、F(4、104)= 260.13, p < .001 η2G = .894。ボンフェローニ調整によるポストホック比較では、すべての群に有意差が認められた。すべての有意な事後比較において、p < .0000001で あった。これらの平均値の差は、より大きかった(最大Mdiff = 35.58%)。
表 1 に、試験した各 mg 濃度の生物活性レベルの平均値、標準偏差、最小値、最大値を示す。(生 物活性が高いほど、また濃度が高いほど、石灰化が抑制されることがわかった。5つの濃度すべて において、生物活性が高くなると、石灰化は指数関数的に減少するように見えた(図1参照)。各 サンプルの石灰化の減少のばらつきも、生物活性が高くなるにつれて大きくなった。例えば、最 も減少率の高いグループ(100 mg、生物活性0.95)は、40%から67%の減少を示した(M =55%)。このグループはまた、最も大きな標準偏差(SD = 6.66%)を有していた。減少率が高く なるとばらつきが大きくなるが、生物活性のレベル間には意味のある違いがあるように思われ た。例えば、すべてのmg濃度において、0.95の生物活性CBDによって誘発された最小石灰化減少 は、0.70の生物活性CBDによって誘発された最大石灰化減少より依然として大きかった。
低生物活性のCBDをmg濃度で比較する
0.20生物活性CBDで処理したVICサンプルの様々なmg濃度(5、10、25、40、100)の間に違い が存在するかどうかを調べるために、1×5の反復測定ANOVAを実施しました(図2参照)。 Mauchleyの検定は、サンプル間の球形性の仮定に違反しないことを見出した、W = 0.759, p = 0.667.RM ANOVAでは、0.20生物活性試験群におけるVIC石灰化減少について投与量間の有意差 が認められた、F(4, 104) = 18.90, p < .001, η2G = .354。ボンフェローニ補正を用いたポスト ホック比較では、25mgと100mgの投与量にさらされた試験サンプルは、5、10、40mgの投与 量よりもVIC石灰化の減少が大きいことが示された。すべての有意なpost-hoc比較において、p < 0.001であった。これらの平均値間の差は小さかった(すべてMdiff < 1.15%)。
高生物活性のCBDをmg濃度で比較する
生物活性0.95のCBDで処理したVICサンプルにおいて、様々なmg濃度の間に違いが存在するかど うかを調べるために、1×5の反復測定ANOVAを実施しました(図2参照)。Mauchleyのテスト は、球形性の仮定に違反する可能性があることを発見しました。Greenhouse-Geisser補正によ る反復測定ANOVAは、0.95生物活性試験群内のVIC石灰化について投与量間の有意差を見出し た、F(4、104)= 260.13, p < .001 η2G = .894。ボンフェローニ調整によるポストホック比較では、すべての群に有意差が認められた。すべての有意な事後比較において、p < .0000001で あった。これらの平均値の差は、より大きかった(最大Mdiff = 35.58%)。
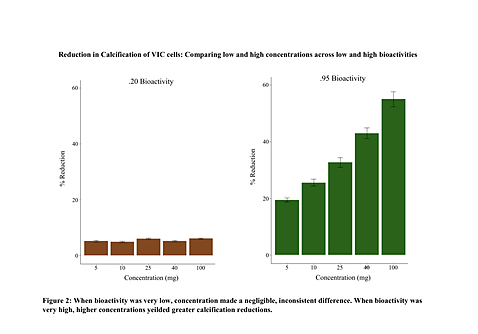
生物活性と濃度の交互作用の検討
生物活性と濃度が高いほど石灰化の減少が大きいという明らかな傾向がデータ全体に見られたため、生物活性と投与量の相互作用の程度をより理解するために、2×2混合ANOVAを試みた。石灰化抑制の増加は、すべてのmg濃度で同様に起こるように見えたので、最低と最高の生物活性と濃 度だけを調べることによって、統計的アプローチを簡素化した。 Leveneの検定は不均質な分散を示し、W = 23.42, p < .001であった。アークサイン変換は分散 を均質にすることができず、W = 16.04, p < .001であった。そこで、中央値推定を用いた Robust 2x2 ANOVAが元の値に対して実施された。その結果、主効果としての生物活性 (psihat = 64.7, p < 0.001)、主効果としての濃度(psihat = -37.5, p < .001)、および生物活性と濃度の間の相互作用(psihat = -36.5, p < .001)に有意な効果があることが判明した。
結論
高い生物活性と濃度では、石灰化が大きく抑制された。低い生物活性では、mg濃度が石灰化抑制 に一貫した役割を果たした。生物活性が高い場合、石灰化抑制効果は濃度が高いほど顕著に増加 した。また,ロバスト推定法により,生物活性と濃度の間に有意な交互作用が認められた。これらの結果を総合すると、CBDの生物活性は、VIC石灰化治療としてのCBDの有効性を考える際に 中心的な重要性を持つことが示唆された。
ディスカッション
本研究では、CBDがin vitroでブタのVIC石灰化を抑制する効果があることが示され、最高濃度の 生物活性の高いCBDが最大の抑制効果を示した(M=55%)。 この実験内で、我々は、CBDが主にVIC石灰化を減少させた最も可能性の高いメカニズムは、 ERK阻害であると判断する(Gu&Masters、2009を参照)。この判断が正しいのであれば、生物活性レベルによる石灰化抑制の差は、ERK活性の抑制の差を意味することになる。このこと は、非常に大きな意味を持つ。 ERK経路は、多様な細胞外刺激を増殖、分化、生存、および血管形成に結びつける(Roy et al, 2001, Salasznyk et al, 2004; Lewis, Shapiro & Ahn, 1998; Depeille, 2007)。癌を含む非常 に多くの疾患が、その調節を通じて影響を受けることができる(例えば、Wagner & Nebreda, 2009; Huang et al., 2008; Herrera, Carracedo, Diez-Zaera, Guzm?n, & Velasco, 2005; Milella et al.)例えば、放射線との組み合わせで、MAPK p38経路は、グリオブラストーマにお けるCBD誘発性細胞死の主なドライバーの1つでした(Ivanov et al.、2017)。さらに、ERKお よびROS経路のCBDによる調節は、Id-1の発現のダウンレギュレーションおよびId-2のアップレ ギュレーションをもたらし、それによって乳がん細胞の増殖および浸潤を阻害する(McAllister ら、2010年)。CBDがこれらの抗癌作用を引き出す程度は、同様にCBDの生物活性に依存する であろう。 Cushingら(2018)に記載されているように、この実験で使用された生物活性試験手順は、その 妥当性がCBDサンプルのCB2親和性に基づくモノクローナル抗体試験で構成されていた。CBD生物活性試験が、GPR55(Lauckner、Jensen、Chen、Lu、Hille、及びMackie、2008)などの 非CB2標的の石灰化低減効果を予測するかどうかは、今のところ不明である。我々は、生物活性が非CB2 経路を介した効果に一般化することを期待している。もしそうであれば、GPR55のような経路に対するプロカルシフィック効果を探るために低い生物活性のCBDを利用した研究は、 誤った結果をもたらしたかもしれません。臨床研究に先立って、CBDのサンプルは生物活性を検 査することが不可欠です。
生物活性と濃度が高いほど石灰化の減少が大きいという明らかな傾向がデータ全体に見られたため、生物活性と投与量の相互作用の程度をより理解するために、2×2混合ANOVAを試みた。石灰化抑制の増加は、すべてのmg濃度で同様に起こるように見えたので、最低と最高の生物活性と濃 度だけを調べることによって、統計的アプローチを簡素化した。 Leveneの検定は不均質な分散を示し、W = 23.42, p < .001であった。アークサイン変換は分散 を均質にすることができず、W = 16.04, p < .001であった。そこで、中央値推定を用いた Robust 2x2 ANOVAが元の値に対して実施された。その結果、主効果としての生物活性 (psihat = 64.7, p < 0.001)、主効果としての濃度(psihat = -37.5, p < .001)、および生物活性と濃度の間の相互作用(psihat = -36.5, p < .001)に有意な効果があることが判明した。
結論
高い生物活性と濃度では、石灰化が大きく抑制された。低い生物活性では、mg濃度が石灰化抑制 に一貫した役割を果たした。生物活性が高い場合、石灰化抑制効果は濃度が高いほど顕著に増加 した。また,ロバスト推定法により,生物活性と濃度の間に有意な交互作用が認められた。これらの結果を総合すると、CBDの生物活性は、VIC石灰化治療としてのCBDの有効性を考える際に 中心的な重要性を持つことが示唆された。
ディスカッション
本研究では、CBDがin vitroでブタのVIC石灰化を抑制する効果があることが示され、最高濃度の 生物活性の高いCBDが最大の抑制効果を示した(M=55%)。 この実験内で、我々は、CBDが主にVIC石灰化を減少させた最も可能性の高いメカニズムは、 ERK阻害であると判断する(Gu&Masters、2009を参照)。この判断が正しいのであれば、生物活性レベルによる石灰化抑制の差は、ERK活性の抑制の差を意味することになる。このこと は、非常に大きな意味を持つ。 ERK経路は、多様な細胞外刺激を増殖、分化、生存、および血管形成に結びつける(Roy et al, 2001, Salasznyk et al, 2004; Lewis, Shapiro & Ahn, 1998; Depeille, 2007)。癌を含む非常 に多くの疾患が、その調節を通じて影響を受けることができる(例えば、Wagner & Nebreda, 2009; Huang et al., 2008; Herrera, Carracedo, Diez-Zaera, Guzm?n, & Velasco, 2005; Milella et al.)例えば、放射線との組み合わせで、MAPK p38経路は、グリオブラストーマにお けるCBD誘発性細胞死の主なドライバーの1つでした(Ivanov et al.、2017)。さらに、ERKお よびROS経路のCBDによる調節は、Id-1の発現のダウンレギュレーションおよびId-2のアップレ ギュレーションをもたらし、それによって乳がん細胞の増殖および浸潤を阻害する(McAllister ら、2010年)。CBDがこれらの抗癌作用を引き出す程度は、同様にCBDの生物活性に依存する であろう。 Cushingら(2018)に記載されているように、この実験で使用された生物活性試験手順は、その 妥当性がCBDサンプルのCB2親和性に基づくモノクローナル抗体試験で構成されていた。CBD生物活性試験が、GPR55(Lauckner、Jensen、Chen、Lu、Hille、及びMackie、2008)などの 非CB2標的の石灰化低減効果を予測するかどうかは、今のところ不明である。我々は、生物活性が非CB2 経路を介した効果に一般化することを期待している。もしそうであれば、GPR55のような経路に対するプロカルシフィック効果を探るために低い生物活性のCBDを利用した研究は、 誤った結果をもたらしたかもしれません。臨床研究に先立って、CBDのサンプルは生物活性を検 査することが不可欠です。
Measuring the bioactivity of phytocannabinoid cannabidiol from cannabis sources, and a novel non-cannabis source.
大麻由来の植物性カンナビノイドcannabidiolと新規の非大麻由来の植物性カンナビノイドの生物活性を測定する。
D. Cushing1*, S. Kristipati2, R. Shastri2, & B. Joseph1 1: Peak Health Center, Los Gatos, CA 2: Endocrine BioTech, Newark, CA
フィトカンナビノイドのカンナビジオール(CBD)は、非常に多くの免疫学的効果を引き出すこ とが示されています。CBDは、カンナビノイド受容体2(CB2)との相互作用により、エンドカン ナビノイド系に作用します。CBD-CB2親和性(私たちは生物活性と呼んでいます)は、臨床サン プルについてほとんど検査されていません。私たちは、生物活性レベルの制御されていない変動が、多くのCBD実験を静かに混乱させていると考えています。私たちの4つの部分からなる研究では、CBD研究をより科学的に制御することを可能にする効率的な生物活性試験を検証します。私たちはそれを使って、異なる植物器官から得られたCBDの生物活性を比較し、また、処理方法が 生物活性を決定する上で役割を果たすかどうかを研究しました。また、Humulus Kriya(H.クリ ヤ、米国特許第15/932,529号、2018年)と名付けられた、商業量のCBDを生産できる新規の非 大麻植物の生物活性と加工要因についても調査しています。また、現在市場で販売されているいく つかのCBD単離物/抽出物の生物活性を試験し、H. Kriyaの花序から抽出されたImmunAGというCBD製品と比較します。その結果、花序から抽出したCBDが最も高い生理活性を示し、次いで 頂芽・葉、葉柄、そして最後に茎であることが分かりました。H. KriyaはCannabis Sativaと同様 の生物活性プロファイルを持つことがわかりました。私たちは、大麻をベースにした商業的な CBD製品の生物活性レベルはかなり低く、変動的であることを発見しました。我々は、 ImmunAGの生物活性レベルが有意に高いことを発見した。
近年、フィトカンナビノイドのカンナビジオール(CBD)に関わる科学的研究が非常に急増して います(Burstein, 2015; Zuardi, 2008)。CBDは、好ましい安全性プロファイルではないにし ても、許容できるものであるように見え(Iffland, & Grotenhermen, 2017; Devinsky et al., 2016)、抗不安、抗うつ、抗精神病、抗痙攣、抗嘔気、抗酸化、抗炎症、抗関節炎、抗新生物で あると示されている(Ligresti, De Petrocellis, & Di Marzo, 2016)。てんかん、不安、精神病、 大脳基底核疾患の動物モデルにおいて保護的であることが示されています(Ligresti, De Petrocellis, & Di Marzo, 2016)。また、抗がん作用も示されている(Pisanti et al.、2017)。 CBDが作用する受容体のうち、カンナビノイド受容体2(CB2)は、免疫系に最も偏在し、よく 研究されている存在です(Malfitano、Basu、Maresz、Bifulco、& Dittel、2014)。CB2は、 NK細胞、B細胞、単球、CD4+細胞、CD8+細胞、T細胞、好中球に存在し(Malfitano, Basu, Maresz, Bifulco, & Dittel, 2014; Tanasescu, Gran, & Constantinescu, 2013; Pacher & Mechoulam, 2011)、炎症および他の免疫機能に対するカナビノイド調節のための主要メディ エーターであると考えられる(Ashton & Glass, 2007; Xiong et al,2012; Lunn et al., 2006; McKallip et al., 2002; McKallip, Lombard, Martin, & Nagarkatti, 2002)があります。
CBDがCB2と相互作用する親和性を生物活性と呼びます1,2。歴史的に、CBDの生物活性試験 は、高価で短命な生物学的ツール(例えば、トランスフェクトされたCHO膜)に依存してきまし た。CBDサンプルの生物活性を試験し、その後臨床試験で使用する実験は、実施に法外な費用と時間がかかってきました。私たちは、生物活性レベルの制御されていない変動が、多くのCBD 実験を無言で混乱させてきたと信じています。
CBDの生物活性のばらつきの根底にある要因は、これまで公的に特定されたことはありません。 考えられる候補は、植物内の器官源と抽出/加工方法です。これらの要因は供給元によって大き く異なります。CBDが伝統的に抽出されてきた植物であるカンナビス・サティバを取り巻く多く の合法性は、慣用的な特殊性を強化しています。米国では、すべての大麻ベースのCBD抽出を連 邦政府が禁止しているにもかかわらず(Mead、2017)、いくつかの州政府は大麻ベースのCBD 製品の供給を認可する独自の法律を持っています(Cambron、Guttmannova、&Fleming、 2017)。州が出資する研究では、合法市場で栽培・使用されているものとは異なるカンナビノイ ドプロファイルを持つ大麻草が利用されています(Vergara et al.、2017)。商業部門の、独立 して運営される、民間組織によって資金提供される研究は、しばしば独自のCBD単離物/抽出物 を利用します(例えば、Frenchら、2017年)。これらを総合すると、法律、規制、慣行は、CBD の生物活性のばらつきの問題を強化する。 本論文では、CBD研究をより科学的に制御することを可能にする、より効率的な生物活性試験を 検証します。我々は、大麻ベースのCBDの生物活性に関与する2つの要因、すなわちCBDが抽出 される植物器官源および抽出方法を探索する。また、Humulus Kriya(H.クリヤ、米国特許第 15/932,529号、2018年)と名付けられた、商業量のCBDを生産できる新規で独自の非大麻植 物の器官ごとの生物活性、および抽出方法について検討します。その後、現在市場で販売されて いるいくつかのCBD単離物/抽出物の生物活性を試験し、生物活性因子が故意に制御されたH. Kriyaから抽出されたCBDと比較します。
CBDの生物活性のばらつきの根底にある要因は、これまで公的に特定されたことはありません。 考えられる候補は、植物内の器官源と抽出/加工方法です。これらの要因は供給元によって大きく異なります。CBDが伝統的に抽出されてきた植物であるカンナビス・サティバを取り巻く多くの合法性は、慣用的な特殊性を強化しています。米国では、すべての大麻ベースのCBD抽出を連 邦政府が禁止しているにもかかわらず(Mead、2017)、いくつかの州政府は大麻ベースのCBD 製品の供給を認可する独自の法律を持っています(Cambron、Guttmannova、&Fleming、 2017)。州が出資する研究では、合法市場で栽培・使用されているものとは異なるカンナビノイ ドプロファイルを持つ大麻草が利用されています(Vergara et al.、2017)。商業部門の、独立 して運営される、民間組織によって資金提供される研究は、しばしば独自のCBD単離物/抽出物 を利用します(例えば、Frenchら、2017年)。これらを総合すると、法律、規制、慣行は、CBD の生物活性のばらつきの問題を強化する。
本論文では、CBD研究をより科学的に制御することを可能にする、より効率的な生物活性試験を 検証します。我々は、大麻ベースのCBDの生物活性に関与する2つの要因、すなわちCBDが抽出される植物器官源および抽出方法を探索する。また、Humulus Kriya(H.クリヤ、米国特許第 15/932,529号、2018年)と名付けられた、商業量のCBDを生産できる新規で独自の非大麻植物の器官ごとの生物活性、および抽出方法について検討します。その後、現在市場で販売されて いるいくつかのCBD単離物/抽出物の生物活性を試験し、生物活性因子が故意に制御されたH. Kriyaから抽出されたCBDと比較します。
脚注
1 生物活性とは、リガンドが意図したターゲットに接触したときに生じる生物学的反応の強さを指す。一般に、生物活性の高いリガンドほど、より顕著な効果をもたらす。生物活性は、バイオア ベイラビリティと混同してはならない。バイオアベイラビリティとは、ある物質が膜を通過して体内の意図した標的に到達するまでの拡散速度のことである。
2 CBDは、CB2受容体作動薬に対して強力な拮抗作用を示し(Pertwee, 2008; Thomas et al.、 2007)、CB2において逆作動薬として機能することも示されています(Pertwee, 2008; Pertwee et al.)CBDは、[35S]GTPγS結合とRho活性化を阻止するアンタゴニストとして働き (Rybergら、2007;Whyteら、2009;Fordら、2010)、Ca2+動員(Laucknerら、2008) 及びβ-アレスチン動員(Yinら、2009)を調節する。CB2インバースアゴニズムは、免疫細胞の 移動をブロックし、炎症を減少させることができる(Lunnら、2006年)。CBDは、マクロ ファージ、ミクログリア細胞および好中球の移動を強力に阻害する(Walterら、2003; Sacerdoteら、2005)。CBDが誘発するマクロファージの化学走性ブロックは、CB2選択的ア ンタゴニストであるSR144528によって防ぐことができる(Sacerdoteら、2005)。CBDは、 ヒトCB2受容体発現CHO細胞によるフォルスコリン刺激サイクリックAMP産生を強力に阻害する (Gauson, Stevenson, Thomas, Baillie, Ross, & Pertwee,2007)。
実験1:新規で有効かつスケーラブルなCBD生物活性試験
2014年にイスラエルのTikun Olamから入手したAvidekel植物から、音波分画と超遠心分離によ り高純度の天然由来CBD分子を抽出した。この参照試料について、組換えヒトCB2を発現する CHO細胞の膜画分を用いた[3h]-CP55940置換アッセイを実施しました。さらに、MCA(米国特 許第62,599,501号、2017年に記載)の結合を、この参照サンプルについて試験した。得られた 変位および結合値を、26個のCBDサンプル(Natural Hemp Solutions, Atlanta Georgiaから取 得)を比較する参照標準として使用した。
26個のサンプル間で、CHO CB2結合、およびMCA結合の間の相関を探しました。もしMCAの 結合がCHO-CB2と相関があれば、より迅速で効率的な試験のために、MCAを代わりに使用することができます。
結果
ピアソン相関分析を行った。
26個のCBDサンプルのCB2およびCACの結合値について、Rを用いて解析した。組換えヒト CB2および最高親和性MCAの両方に対する結合親和性を、高純度CBD分子が示す結合親和性に対 する割合として表1に示す。ピアソン相関分析を用いると、これらは高い相関があることがわかり ました(ピアソン係数=0.97)。このように、MCAを用いてCBDの生物活性を高い精度で予測することができます。
ディスカッション
我々は、CBDの生物活性試験を成功させ、拡張可能であることを検証した。生物活性値は、我々が単離することができた最も純粋なCBD分子のCHO-CB2結合と比較して、0と1の間の割合として表されます。数値が低いほど、生物活性が低いことを意味します。CBD分子の生物活性が0.5以 下であれば、生物活性が1の分子の半分の強さでCBD-CBD2結合が観察されると予想されます。 もしある分子の生物活性が0.2であれば、生物活性が1の分子の5分の1の強さで結合親和性があると予想できます。このテストにより、植物の様々な部分における生物活性分子の分布が明らかになります。
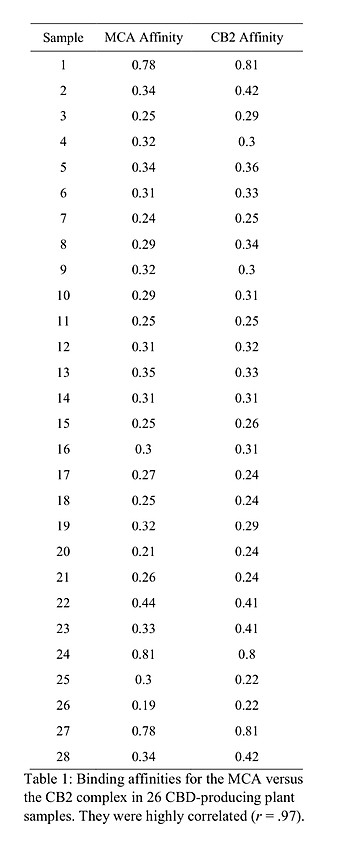
表1:CBD産生植物26検体におけるMCA対CB2複合体の結合親和性。両者は高い相関を示した(r = 0.97)。
実験2:植物器官による大麻CBDの生物活性の違い
生産者の間では、CBDの収量が大麻草の異なる器官で変動し、花序が最も多く生産されることが よく知られています3。(しかし、異なる器官から抽出されたCBDの生物活性は、これまで研究さ れたことがありません。 実験1で検証した生物活性試験を用いて、米国、インド、中国、チェコ共和国から入手した48種 類の大麻の栽培品種から4つの部位を調べました。花序、葉柄、頂芽・葉、茎を別々に試験した。 花序については、音波分画と超遠心分離を組み合わせて精製試料を得ました。また、花序、葉 柄、頂芽/葉、茎からCBDを得るために、冷媒抽出を行った。
結果
植物器官を唯一の因子として、生物活性について1×5 ANOVA および適切なポストホック比較を 行った。生物活性の平均値と標準誤差がプロットされた。 Leveneの検定では、器官間の不均一分散が示された F(4,235) = 6.05, p < 0.001.そのため、 Wilcox (2012)で説明されているように、ロバストANOVAを実施した。その結果、遠心分離機で 抽出した花序のCBD(M = .96, SD = .02、花序から溶媒抽出したCBD(M = .86, SD = .02) の生物活性の間に有意差があることがわかりました。04)、葉柄からの溶媒抽出CBD(M= .54, SD = .03)、頂芽/葉からの溶媒抽出CBD(M = .4, SD = .04)、茎からの溶媒抽出CBD (M = .19, SD = .02), F(4, 70.38) = 9885.21, p < .001.であった。(20%トリミングされた平 均値が上に示されている)。 ロバストなポストホック比較(Mair & Wilcox, 2016)により、CBDソースの各カテゴリー間で 有意差があることが明らかになった。(各比較のpsihat値、および関連する信頼区間は表2を参 照)。要約すると、最も生物活性の高いCBDは各植物のさやで見つかり、葉柄、頂芽/葉、茎では それぞれ生物活性が低下していました(図1参照)。
考察
その結果、抽出方法の違いによる差が見られました。音波分画と超遠心分離の組み合わせによ り、最も高い生理活性を持つ CBD が得られた。音波分画と超遠心分離抽出は、労力と設備がか かる実験室での作業であり、大規模な製造には適さない。これに対し、エタノール溶媒抽出は、生 理活性の低下はわずかですが、スケーラブルで比較的安価に実施することが可能です。そのため、 商業的なCBDの生産には、より一般的な手順となっています4。 エタノール抽出に供された植物器官の中で、私たちの結果は、CBDの生物活性の正統的なパター ンを示しています。花序は、最も高い生物活性のCBD分子を生成し、そのレベルは茎から抽出さ れたCBDよりも5倍高い。花序は、高い生物活性のCBDの生産のためにのみ使用されるべきです。商業的なCBDサプライヤーが抽出前に植物の茎と樹皮からのバイオマスを混合した場合、 それは低い生物活性になることは明白です。
実験2:植物器官による大麻CBDの生物活性の違い
生産者の間では、CBDの収量が大麻草の異なる器官で変動し、花序が最も多く生産されることが よく知られています3。(しかし、異なる器官から抽出されたCBDの生物活性は、これまで研究さ れたことがありません。 実験1で検証した生物活性試験を用いて、米国、インド、中国、チェコ共和国から入手した48種 類の大麻の栽培品種から4つの部位を調べました。花序、葉柄、頂芽・葉、茎を別々に試験した。 花序については、音波分画と超遠心分離を組み合わせて精製試料を得ました。また、花序、葉 柄、頂芽/葉、茎からCBDを得るために、冷媒抽出を行った。
結果
植物器官を唯一の因子として、生物活性について1×5 ANOVA および適切なポストホック比較を 行った。生物活性の平均値と標準誤差がプロットされた。 Leveneの検定では、器官間の不均一分散が示された F(4,235) = 6.05, p < 0.001.そのため、 Wilcox (2012)で説明されているように、ロバストANOVAを実施した。その結果、遠心分離機で 抽出した花序のCBD(M = .96, SD = .02、花序から溶媒抽出したCBD(M = .86, SD = .02) の生物活性の間に有意差があることがわかりました。04)、葉柄からの溶媒抽出CBD(M= .54, SD = .03)、頂芽/葉からの溶媒抽出CBD(M = .4, SD = .04)、茎からの溶媒抽出CBD (M = .19, SD = .02), F(4, 70.38) = 9885.21, p < .001.であった。(20%トリミングされた平 均値が上に示されている)。 ロバストなポストホック比較(Mair & Wilcox, 2016)により、CBDソースの各カテゴリー間で 有意差があることが明らかになった。(各比較のpsihat値、および関連する信頼区間は表2を参 照)。要約すると、最も生物活性の高いCBDは各植物のさやで見つかり、葉柄、頂芽/葉、茎では それぞれ生物活性が低下していました(図1参照)。
考察
その結果、抽出方法の違いによる差が見られました。音波分画と超遠心分離の組み合わせによ り、最も高い生理活性を持つ CBD が得られた。音波分画と超遠心分離抽出は、労力と設備がか かる実験室での作業であり、大規模な製造には適さない。これに対し、エタノール溶媒抽出は、生 理活性の低下はわずかですが、スケーラブルで比較的安価に実施することが可能です。そのため、 商業的なCBDの生産には、より一般的な手順となっています4。 エタノール抽出に供された植物器官の中で、私たちの結果は、CBDの生物活性の正統的なパター ンを示しています。花序は、最も高い生物活性のCBD分子を生成し、そのレベルは茎から抽出さ れたCBDよりも5倍高い。花序は、高い生物活性のCBDの生産のためにのみ使用されるべきです。商業的なCBDサプライヤーが抽出前に植物の茎と樹皮からのバイオマスを混合した場合、 それは低い生物活性になることは明白です。
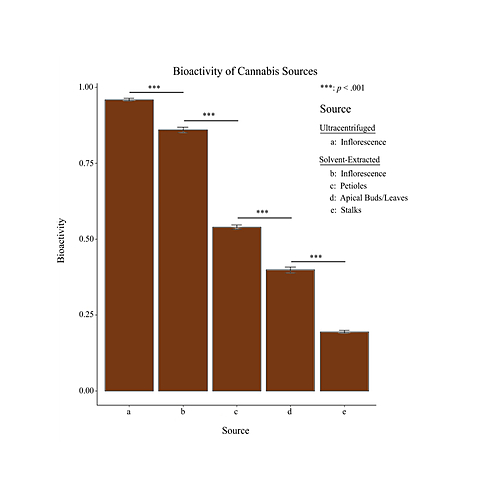
図1:花序が最も高い生物活性を示すという、極めて正統的なパターンが出現した。aは超遠心分離によって得られた。b、c、d、eは冷溶媒エタノール抽出により得られた。上記の標準誤差は、統計的に最も保守的な推定値を示すために、トリミングされていない平均値からのものです。
実験3:大麻ではない新規の植物性CBD供給源の生理活性を調べる
CBDを生成するカラハナソウ属の植物を用いて、フムルス・クリヤという新しい植物が開発されました。 THCを生成せず、GRAS(FDA Title 21, Volume 3, Sec 182.2- CAS 8060-28-4)とされる植物の仲間で、FSSAI(インド食品安全基準局)により「食品成分」として認定されています。 Scheduled Listの分類には該当しないはずです。実験2と同じ方法で、H.クリヤの各部位の生物活性プロファイルをテストしました。
訳注:学名Humulus lupulus(フムルス ルプルス)はホップのこと
植物学的にはアサ科、カラハナソウ属、ホップ(種)
結果
サンプルは、6つのH.Kriyaの植物6本と、ImmunAGのオイル抽出物31サンプルを使用した。 ウェルチのtを用いて、5つのグループのH. Kriyaと大麻サンプルのCBD生物活性を比較した(植 物ごとに得られた個々の生物活性スコアは、付録2に記載)。H. Kriyaからの遠心分離されたポッ ドCBD(M = 0.95, SD = 0.01)は、大麻サンプルと比較して生物活性に差を示さなかった、t (8.6594)= 1.74, p = 0.12。溶媒抽出されたポッドCBD(M = 0.86, SD = 0.06)は、差を示さず、t(5.3803) = 0.007, p = .99となりました。溶媒抽出した葉柄CBD(M = .54, SD = .01) は、差を示さず、t(14.123) = 0.373, p = .715となった。溶媒抽出された葉CBD (M = .41, SD = .04)は、差を示さず、t(6.164) = -1.0212, p = .346となった。溶媒抽出された茎CBD (M= .20, SD = .01)は、差を示さず、t(7.322) = -1.143, p = .289となった。H. Kriyaは、私たちが テストした大麻株と同一のCBD生物活性プロファイルを持っているかのように見えます。比較は 図2に示されています。
ディスカッション
我々は、植物の様々な部分から抽出されたCBDについて、H. Kriyaと大麻の間で同一のCBD生物活性を見いだした。H. Kriyaは、CBD研究のための実行可能な大麻の代替品であると思われます。H. KriyaからのCBDは、THC汚染のリスクがありません。インド食品安全基準局から食品成分として認定されています。
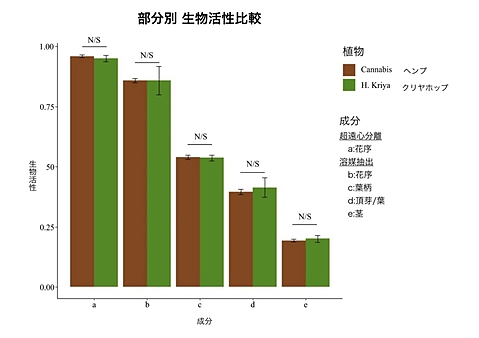
図2:H.クリヤと大麻の間には、いずれの部位においても有意な差は認められなかった。
実験4:市販のCBD製品の生物活性を調べる
市販のCBDサンプルの生物活性はこれまで検証されたことがありません。私たちは、過去2年間 に分析した市販の麻を原料とする製品の結果を公表しています。これらのサンプルは、業者 (Natural Hemp Solutions、Centuria Foods、BSPG、Isodiol、Hammer Enterprisesなど) から直接送られてきたり、第3者から送られてきたりしました。個々のベンダーの生物活性の結果は意図的に公表せず、すべてのベンダーの生物活性の結果をまとめて匿名で発表しています。 CBD以外にも多くのカンナビミメティック分子が存在します。大麻・カンナビス以外からのCBD の供給源として発表されているのは、酵母とフムルスです。しばらく試みましたが、酵母から抽出した CBDのサンプルは手に入りませんでした。H・クリヤ(ImmunAG)から抽出したCBDの生物活性を調べ、市販の麻由来の製品と比較しました。
結果
市販サンプルの生物活性は最小で0.11、最大で0.41でした。ImmunAGの生物活性は最小で 0.72、最大で0.98でした。両クラスの製品の生物活性スコアを図3に示します。 ImmunAGのCBDの生物活性(M = .88, SD = .06)と市販の製品(M = .23, SD = .07)を比較 したところ、Welchのtは、生物活性に有意差、t(41.288)= 53.41, p < .001があることを発見 しました。
実験4:市販のCBD製品の生物活性を調べる
市販のCBDサンプルの生物活性はこれまで検証されたことがありません。私たちは、過去2年間 に分析した市販の麻を原料とする製品の結果を公表しています。これらのサンプルは、業者 (Natural Hemp Solutions、Centuria Foods、BSPG、Isodiol、Hammer Enterprisesなど) から直接送られてきたり、第3者から送られてきたりしました。個々のベンダーの生物活性の結果は意図的に公表せず、すべてのベンダーの生物活性の結果をまとめて匿名で発表しています。 CBD以外にも多くのカンナビミメティック分子が存在します。大麻・カンナビス以外からのCBD の供給源として発表されているのは、酵母とフムルスです。しばらく試みましたが、酵母から抽出した CBDのサンプルは手に入りませんでした。H・クリヤ(ImmunAG)から抽出したCBDの生物活性を調べ、市販の麻由来の製品と比較しました。
結果
市販サンプルの生物活性は最小で0.11、最大で0.41でした。ImmunAGの生物活性は最小で 0.72、最大で0.98でした。両クラスの製品の生物活性スコアを図3に示します。 ImmunAGのCBDの生物活性(M = .88, SD = .06)と市販の製品(M = .23, SD = .07)を比較 したところ、Welchのtは、生物活性に有意差、t(41.288)= 53.41, p < .001があることを発見 しました。

図3:H. KriyaベースのImmunAGは、すべてのサンプルにおいて、麻ベースの市販品よりも高い生物活性を示す。
ディスカッション
市販のCBD の生物活性は低く、低生物活性器官である茎、幹、樹皮、葉と一致する値でした。 供給者は、規制を遵守し、質量を増やすために、茎、幹、葉を多く含むバイオマスを使用してきた可能性があります。注意すべきは、生物活性の低いCBDは、望ましいほど強い免疫学的細胞シ グナルを生成しないかもしれないということです。市販のCBDの生物活性もかなりばらつきがあり、最小0.11、最大0.41でした。最も高い市販のサンプルは、最も低いサンプルのほぼ4倍の力 価を持っていました。生物活性の低いCBDを放置しておくと、医療用や研究を混乱させ、偽りの結果を生み出す可能性があります。 ImmunAGのサンプルは0.72から0.98の範囲で、最も低いImmunAGの生物活性は最も高い市販 の麻ベースのCBD生物活性より高いものでした。ImmunAGはH. Kriyaの花序からしか作られて いないため、これは驚くべきことではありません。監査の結果、慎重に規制された加工条件もまた、ImmunAGが著しく高い生物活性を維持することを可能にしていることが明らかになりまし た。加工条件がCBDの生物活性に及ぼす影響については、追って論文で発表する予定です。
結論
CBDの生物活性のモノクローン抗体検査は実行可能であることがわかりました。植物器官によって抽 出されたCBDの生理活性が異なり、花序が最も生理活性が高く、茎・幹が最も低いことがわかりました。我々は、麻と同様の生物活性プロファイルを持つ非麻のCBD産生植物、H. Kriyaを 評価しました。市販されている麻ベースのCBD製品は、生物活性が低いことがわかりまし た。そのH.Kriyaから作られた市販のCBD製品は、最も高い生物活性を持つことが分かりました。 CBD-CB2相互作用は、幅広い免疫学的効果に関与しています。私たちが調査したサンプルは、生物活性のレベルが大きく異なっていました。私たちは、生物活性のレベルが歴史的な研究結果を 静かに混乱させている可能性が高いと信じています。CBDを医学研究に利用する科学的研究は、 最も高い生物活性レベルを持つ製品を使用するように努力すべきです。
ディスカッション
市販のCBD の生物活性は低く、低生物活性器官である茎、幹、樹皮、葉と一致する値でした。 供給者は、規制を遵守し、質量を増やすために、茎、幹、葉を多く含むバイオマスを使用してきた可能性があります。注意すべきは、生物活性の低いCBDは、望ましいほど強い免疫学的細胞シ グナルを生成しないかもしれないということです。市販のCBDの生物活性もかなりばらつきがあり、最小0.11、最大0.41でした。最も高い市販のサンプルは、最も低いサンプルのほぼ4倍の力 価を持っていました。生物活性の低いCBDを放置しておくと、医療用や研究を混乱させ、偽りの結果を生み出す可能性があります。 ImmunAGのサンプルは0.72から0.98の範囲で、最も低いImmunAGの生物活性は最も高い市販 の麻ベースのCBD生物活性より高いものでした。ImmunAGはH. Kriyaの花序からしか作られて いないため、これは驚くべきことではありません。監査の結果、慎重に規制された加工条件もまた、ImmunAGが著しく高い生物活性を維持することを可能にしていることが明らかになりまし た。加工条件がCBDの生物活性に及ぼす影響については、追って論文で発表する予定です。
結論
CBDの生物活性のモノクローン抗体検査は実行可能であることがわかりました。植物器官によって抽 出されたCBDの生理活性が異なり、花序が最も生理活性が高く、茎・幹が最も低いことがわかりました。我々は、麻と同様の生物活性プロファイルを持つ非麻のCBD産生植物、H. Kriyaを 評価しました。市販されている麻ベースのCBD製品は、生物活性が低いことがわかりまし た。そのH.Kriyaから作られた市販のCBD製品は、最も高い生物活性を持つことが分かりました。 CBD-CB2相互作用は、幅広い免疫学的効果に関与しています。私たちが調査したサンプルは、生物活性のレベルが大きく異なっていました。私たちは、生物活性のレベルが歴史的な研究結果を 静かに混乱させている可能性が高いと信じています。CBDを医学研究に利用する科学的研究は、 最も高い生物活性レベルを持つ製品を使用するように努力すべきです。
